Theranostika na bázi fluorovaných polymerů – diagnostika a terapie nádorové tkáně pomocí fluorové magnetické resonance s cíleným uvolňováním léčiva
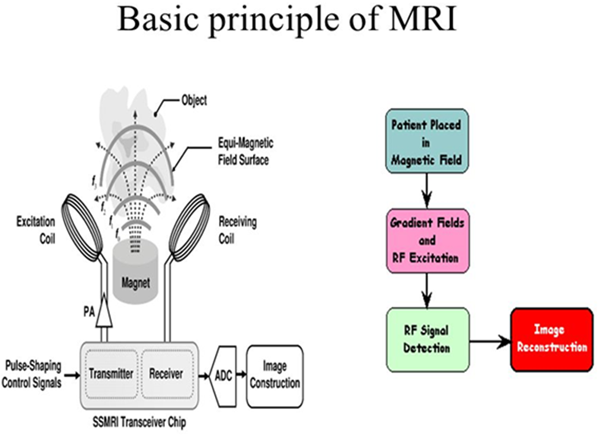
Diagnostika nádorové tkáně je v současné době možná pomocí široké škály zobrazovacích metod. Každá metoda má své výhody ale i slabé stránky, díky čemuž je stále snaha prozkoumávat nové možnosti a vylepšovat či obměňovat současný stav již dostupných zobrazovacích technik. Magnetická resonance (v současnosti hlavně využívající jádra vodíku – protony – ve v organismu všudypřítomné vodě) je velice vyhledávanou metodou hlavně z důvodu její neinvazivity, tzn. nepoškozování tkáně a zdraví člověka v průběhu měření. Její nevýhodou jsou často těžce vyhodnotitelná výstupní data, kde lokalizace poškozené tkáně nebývá vždy jednoduchá. Pro vylepšení kontrastu se začalo využívat kontrastních látek, obvykle na bázi paramagnetických těžkých kovů jako je gadolinium. Tyto látky fungují na principu změny relaxace protonů v molekule vody, a tudíž je voda přítomná v okolí kontrastní látky rozlišitelná od vody, kde se kontrastní látka nenachází. Tímto vnikne odlišitelný signál na magnetické resonanci a lze poškozenou tkáň velice přesně lokalizovat. Nevýhoda těchto látek je velice očividná a tj. jejich složení. Akumulace těžkých kovů v lidském těle má povětšinou vážné následky, což v tomto případě může nastat, a to hlavně z důvodu potřeby poměrně vysoké koncentrace kontrastního činidla, která je nutná v případě magnetické resonance.
Řešení tohoto problému je v myšlence měření jiného magneticky aktivního jádra oproti protonům, přítomným ve vodě kolující v lidském těle. Měření jiných magneticky aktivních jader pomocí magnetické resonance je běžnou praxí v laboratoři, avšak za použití přístrojů k odlišným účelům, zejména k určení složení neznámého vzorku. Měření fluorových jader se z hlediska využití pro medicinální účely zdá velice slibné. Látky obsahující fluor jsou velice hojně zastoupeny v lécích, či drogerii, ale i předmětech každodenní spotřeby (teflonové pánve) atd. a to hlavně z důvodu jejich nízké, či žádné toxicitě pro živé organismy. Další neméně důležitá vlastnost fluoru, je jeho velice podobné magnetické chování jako u vodíku. To má za následek, že je v současné době možné měřit fluor na stejném klinickém přístroji, kde se v praxi měří klasická magnetická resonance a lze kombinovat . Fluorová magnetická resonance se tedy dá měřit bez pořizování nových velice drahých přístrojů a dá se kombinovat s měřením protonů. Poslední výhodou je také fakt, že fluor se přirozeně v těle savců vyskytuje v zanedbatelné koncentraci z hlediska měřitelnosti na magnetické resonanci a tudíž, použijeme-li kontrastní látku obsahující fluor, máme pouze minimální pozadí.
Tým vědců z Ústavu makromolekulární chemie Akademie věd České republiky, v.v.i. v Praze pod vedením Dr. Martina Hrubého ve spolupráci s Dr. Ondřejem Sedláčkem z University v Ghentu a specialistou na zobrazování magnetickou resonancí Dr. Danem Jirákem a jeho týmem pracovníků z Institutu klinické a experimentální medicíny v Praze Krči se již dlouhodobě zabývají přípravou nových fluorovaných polymerních kontrastních látek. Součástí výzkumu je příprava složitých systémů na bázi biokompatibilních polymerů obsahujících vysoké koncentrace fluoru, jejich charakterizaci a měření na různých biologických modelech. V současné době se připravuje a bylo publikováno několik variabilních systémů na bázi poly[N-(2,2-diflourethylakrylamidu)], využitelné jako tzv. theranostika. Theranostikum je látka, kde je možné kombinovat therapii a diagnostiku poškozené či nemocné tkáně. V tomto případě se jedná o tzv. multiresponsivní polymery s dolní kritickou rozpouštěcí teplotou (LCST). Tyto polymery zůstávají molekulárně rozpustné při laboratorní teplotě a po zahřátí na tělesnou teplotu tvoří supramolekulátní samouspořádané sferické částice (dosahující velikostí od 30 do 150 nm) nebo se zcela vysráží z roztoku, a tudíž při injekci do těla tvoří polymerní implantát. Částice se využívají pro cílené doručování léčiva, které jsou schopné pojmout dovnitř své kavity. Mechanismus doručení do nádorové tkáně je v tomto případě založen na principu tzv. ,,Enhanced Permeability and Retention,“ (EPR) efektu. Jedná se o vlastnost typickou pouze pro nádorovou a některé typy zánětlivých tkání, kde jsou částice o určité velikostní škále (20 – 200 nm) akumulovány v nádorové tkáni. Nádorová tkáň si vytváří prostupnější cévy, aby byla lépe zásobována živinami a mohla růst rychleji, což je jeden z typických příznaků chování poškozené buňky, a zároveň již nemá vlastní vylučování a tyto látky se v ní akumulují. Po akumulaci těchto fluorovaných polymerních kuliček by tedy bylo možné kontrastní látku detekovat. Výše zmíněná multiresponsivita v případě těchto systémů však neznamená tedy pouze citlivost na teplotu (vytvoření částic při teplotě lidského těla) ale také je možné vytvořit systém citlivý na nižší pH či oxidativní podmínky. Nižší pH a přítomnost kyslíkových radikálů (oxidativní podmínky) je další typickou vlastností nádorové a zánětlivé tkáně. Toho se dá využít k cílenému rozpadu částic v místě nádoru či zánětu a tím vyloučením léčiva z kavity částice. Tímto tedy docílíme výše zmíněné současné terapie a diagnózy, tzv. theranostiky.
Polymerní implantáty fungují na stejném principu, avšak jejich aplikace je přímo do nádoru, kde se díky změně z pokojové teploty na tělesnou vytvoří pevný implantát. Pokud s ním injekujeme léčivo, zůstane toto léčivo ,,zapouzdřené,“ v implantátu. Léčivo se pak zvolna uvolňuje z implantátu a současně je možné současně sledovat, jak polymerní implantát degraduje fluorovou magnetickou rezonancí.
Kolouchova, O. Sedlacek, D. Jirak, D. Babuka, J. Blahut, J. Kotek, M. Vit, J. Trousil, R. Konefał, O. Janouskova, B. Podhorska, M. Slouf, M. Hruby: Self-assembled thermoresponsive polymeric nanogels for 19F MR imaging. Biomacromolecules. Roč. 19, č. 8 (2018), s. 3515-3524.
O. Sedlacek, D., Jirak, A. Galisova, E., Jager, J. E. Laaser, T., P. Lodge, P., Stepanek, M. Hruby: 19F magnetic resonance imaging of injectable polymeric implants with multiresponsive behavior. Chemistry of Materials. Roč. 30, č. 15 (2018), s. 4892-4896.