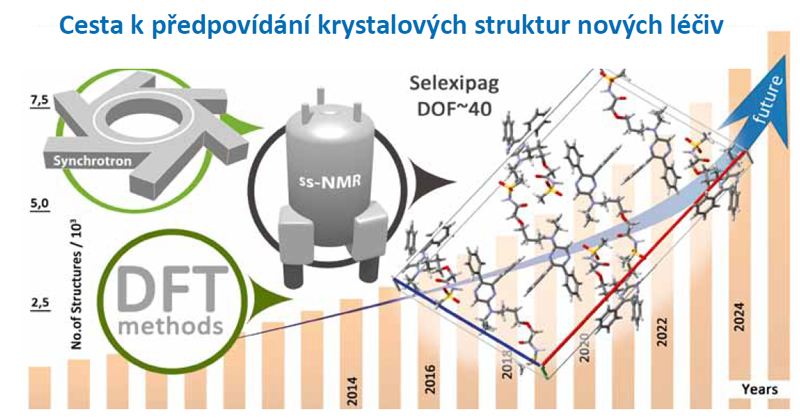
Předpovídání krystalových struktur bylo až do začátku devadesátých let minulého století považováno za nemožné. V roce 1988 redaktor časopisu Science John Maddox dokonce napsal, že jedním z přetrvávajících skandálů fyzikálních věd je nemožnost předvídat strukturu i těch nejjednodušších krystalických látek z jejich chemického složení. Proto navrhoval sestrojit výkonný počítač, vybavit ho sofistikovaným programem. „Po zadání vzorce chemické látky musí být přeci jednoduché získat souřadnice atomů v krystalové buňce.“ Přestože John Maddox problémy predikce krystalových struktur v mnohém podcenil, došlo během posledních 10 let ke značnému pokroku a možná i průlomu. V dnešní době již předpovídání krystalových struktur není primárně motivováno touhou po poznání, ale je motivováno komerčními a ekonomickými faktory. Předpovídání krystalových struktur se totiž ukázalo jako značně přínosné pro vývoj nových typů a forem léčiv. Z těchto důvodů se pak věnuje vývoji spolehlivých a automatizovaných algoritmů predikce a ověřování krystalových struktur léčiv značná pozornost. Koncentrovaný výzkum pracovišť pěti subjektů zahrnující farmaceutickou společnost TEVA Pharmaceutics CR, dva ústavy AV ČR (Ústav makromolekulární chemie a Fyzikální ústav), Vysokou školu chemicko- -technologickou v Praze a zahraniční pracoviště pro pokročilá synchrotronová měření (ESRF – European Synchrotron Radiation Facility) vedl nedávno k vypracování velmi spolehlivé experimentálně-výpočetní strategie umožňující strukturní stanovení i velmi složitých systémů se značným stupněm volnosti. Příkladem může být léčivo určené pro léčbu plicní arteriální hypertenze selexipag. Toto léčivo reprezentuje krystalograficky velmi rozsáhlý systém s 38 stupni volnosti a patří tak v současnosti k největším systémům, jejichž krystalová struktura byla určena z práškových rtg. dat. Lze očekávat, že takovýto nástroj se do budoucna stane standardním vybavením analytických laboratoří farmaceutických společností. A tak se díky schopnosti přesně popsat všechny procesy, ke kterým dochází při výrobě a formulaci léčiv, otvírá další cesta k optimalizaci nových vysoce aktivních léčiv.
Michal Hušák, Alexandr Jegorov, Jiří Czernek, Jan Rohlíček, Simona Žižková, Pavel Vraspír, Pavel Kolesa, Andrew Fitch and Jiří Brus
Cryst. Growth Des. 2019, 19, 4625−4631 DOI: 10.1021/acs.cgd.9b00517